Exemplos De Força De Dispersão De London, também conhecidas como forças de Van der Waals, são forças intermoleculares que surgem devido à flutuação temporária da densidade eletrônica em moléculas. Essas forças, embora consideradas fracas, desempenham um papel fundamental em muitas propriedades físicas e químicas de substâncias, incluindo seus pontos de ebulição, solubilidade e interações intermoleculares.
Ao analisarmos os exemplos de forças de dispersão de London, podemos observar como essas forças influenciam a interação entre moléculas, determinando o estado físico de uma substância em temperatura ambiente. A força dessas forças depende do tamanho, da forma e da polarizabilidade das moléculas, e sua compreensão é crucial para entender o comportamento de diversos compostos químicos.
Introdução às Forças de Dispersão de London
As forças de dispersão de London, também conhecidas como forças de Van der Waals, são um tipo de força intermolecular fraca que surge entre todas as moléculas, independentemente de sua polaridade. Essas forças são responsáveis por atrações intermoleculares transitórias que influenciam as propriedades físicas de muitas substâncias, como ponto de ebulição e solubilidade.As forças de dispersão de London surgem devido à flutuação temporária da densidade eletrônica em moléculas.
Mesmo em moléculas apolares, como o metano (CH4), os elétrons estão em constante movimento, e em um determinado instante, a distribuição eletrônica pode ser ligeiramente distorcida, criando um dipolo instantâneo. Esse dipolo instantâneo, por sua vez, induz um dipolo instantâneo em uma molécula vizinha, levando a uma atração fraca entre elas.
Importância das Forças de Dispersão de London
As forças de dispersão de London, apesar de serem fracas, desempenham um papel crucial na química. Sua importância se manifesta em diversos aspectos:* Ponto de Ebulição:As forças de dispersão de London são as únicas forças intermoleculares presentes em substâncias apolares, como o gás nobre hélio (He) e o metano (CH4).
A força dessas forças aumenta com o tamanho e a forma da molécula, o que explica por que o ponto de ebulição de substâncias apolares aumenta com o aumento da massa molar.
Solubilidade
As forças de dispersão de London também influenciam a solubilidade de substâncias. Substâncias apolares tendem a se dissolver em outras substâncias apolares, pois as forças de dispersão de London entre as moléculas do soluto e do solvente são mais fortes do que as forças entre as moléculas do soluto e do solvente polar.
Viscosidade
A viscosidade de um líquido é uma medida de sua resistência ao fluxo. As forças de dispersão de London influenciam a viscosidade de líquidos, pois as moléculas mais fortemente atraídas umas às outras resultam em uma viscosidade maior.
Fatores que Influenciam a Força de Dispersão de London
As forças de dispersão de London, também conhecidas como forças de Van der Waals, são forças intermoleculares fracas que surgem devido à flutuação temporária na distribuição de elétrons em moléculas. Essas forças são importantes porque afetam as propriedades físicas de substâncias, como o ponto de ebulição, a viscosidade e a solubilidade.
A força dessas forças é influenciada por vários fatores, incluindo o tamanho e a forma das moléculas, a polarizabilidade e a presença de elétrons mais externos.
Tamanho e Forma das Moléculas
O tamanho e a forma das moléculas desempenham um papel crucial na determinação da força das forças de dispersão de London. Moléculas maiores e mais extensas geralmente exibem forças de dispersão de London mais fortes do que moléculas menores e mais compactas.
Isso ocorre porque moléculas maiores possuem mais elétrons, o que aumenta a probabilidade de flutuações temporárias na distribuição de elétrons. Essas flutuações criam momentos dipolares temporários que induzem momentos dipolares em moléculas adjacentes, resultando em uma atração intermolecular mais forte.
- Por exemplo, o butano (C 4H 10) tem um ponto de ebulição mais alto do que o propano (C 3H 8) devido ao seu tamanho maior e maior capacidade de polarização.
- Da mesma forma, o n-pentano (C 5H 12) tem um ponto de ebulição mais alto do que o isopentano (C 5H 12) devido à sua forma mais linear, que permite maior interação entre as moléculas.
Polarizabilidade
A polarizabilidade é uma medida da capacidade de uma molécula de ter sua nuvem de elétrons distorcida por um campo elétrico externo. Moléculas com alta polarizabilidade são facilmente polarizadas e, portanto, exibem forças de dispersão de London mais fortes.
- A polarizabilidade é influenciada pelo número de elétrons e pela facilidade com que esses elétrons podem ser deslocados. Moléculas com muitos elétrons ou elétrons mais externos, que são menos fortemente ligados ao núcleo, são mais polarizáveis.
- Por exemplo, o iodo (I 2) tem um ponto de ebulição muito mais alto do que o flúor (F 2) devido à sua maior polarizabilidade.
Presença de Elétrons Mais Externos
A presença de elétrons mais externos, que são menos fortemente ligados ao núcleo, aumenta a polarizabilidade da molécula. Esses elétrons podem ser facilmente deslocados por campos elétricos externos, levando a flutuações temporárias na distribuição de elétrons e, portanto, a forças de dispersão de London mais fortes.
- Por exemplo, o bromo (Br 2) tem um ponto de ebulição mais alto do que o cloro (Cl 2) devido à presença de elétrons mais externos no bromo.
Exemplos de Forças de Dispersão de London
As forças de dispersão de London são a força intermolecular mais fraca, mas são importantes porque estão presentes em todas as moléculas. Essas forças surgem da formação temporária de dipolos induzidos em moléculas devido ao movimento aleatório de elétrons. As forças de dispersão de London são mais fortes em moléculas maiores e mais polarizáveis.
Substâncias com Forças de Dispersão de London Dominantes
Aqui estão alguns exemplos de substâncias que são mantidas juntas principalmente pelas forças de dispersão de London. A força relativa das forças de dispersão de London pode ser comparada examinando os pontos de ebulição dessas substâncias. Um ponto de ebulição mais alto indica forças intermoleculares mais fortes.
| Substância | Estado Físico à Temperatura Ambiente | Ponto de Ebulição (°C) |
|---|---|---|
| Hélio (He) | Gás | -268,9 |
| Neônio (Ne) | Gás | -246,1 |
| Argônio (Ar) | Gás | -185,8 |
| Criptônio (Kr) | Gás | -153,4 |
| Xenônio (Xe) | Gás | -108,1 |
| Metano (CH4) | Gás | -161,5 |
| Etano (C2H6) | Gás | -88,6 |
| Propano (C3H8) | Gás | -42,1 |
| Butano (C4H10) | Gás | -0,5 |
| Pentano (C5H12) | Líquido | 36,1 |
Como pode ser observado na tabela, o ponto de ebulição aumenta à medida que o tamanho da molécula aumenta. Isso ocorre porque moléculas maiores têm mais elétrons, o que torna mais fácil induzir dipolos temporários. Como resultado, as forças de dispersão de London são mais fortes em moléculas maiores, levando a pontos de ebulição mais altos.
Importância das Forças de Dispersão de London
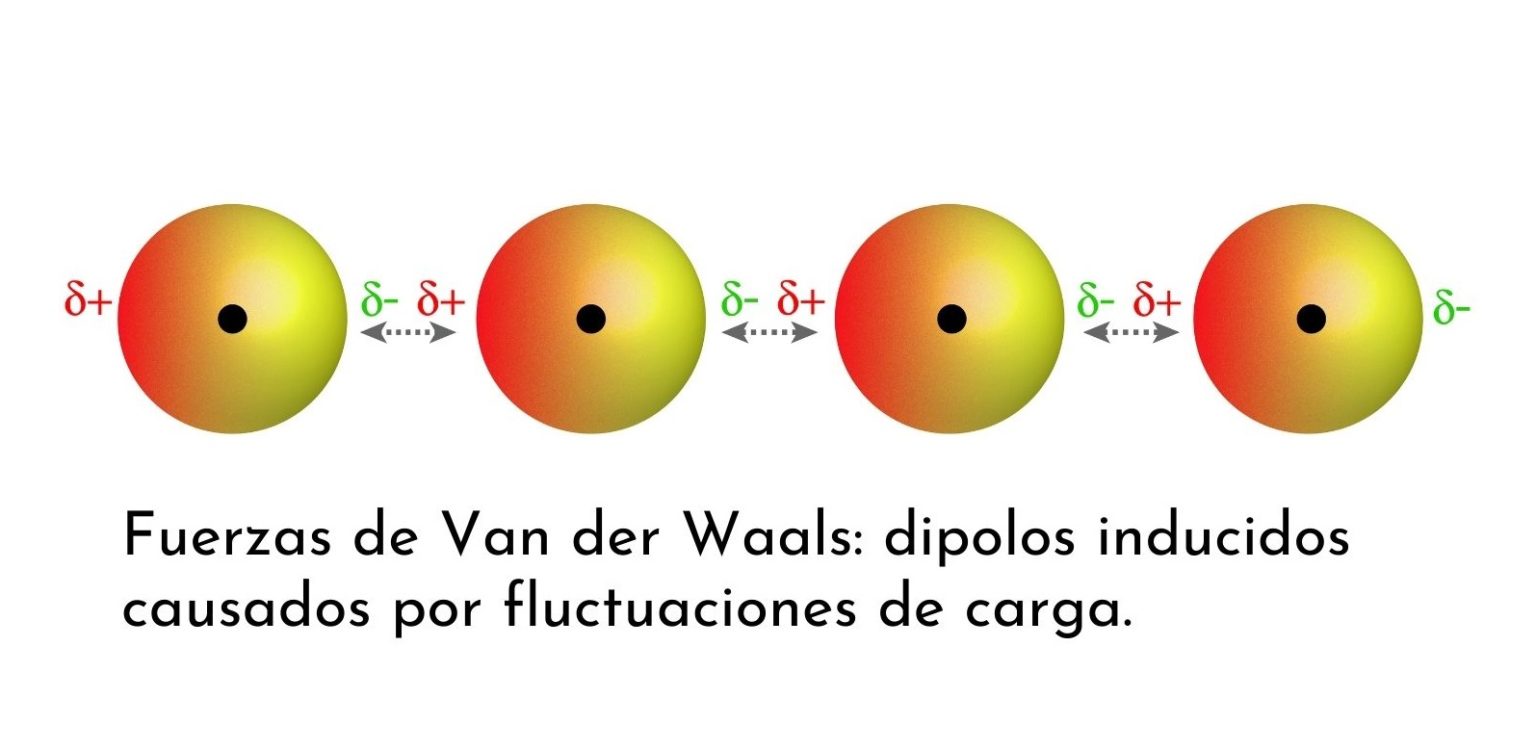
As forças de dispersão de London, também conhecidas como forças de Van der Waals, são forças intermoleculares que desempenham um papel crucial na determinação das propriedades físicas e químicas de uma ampla variedade de substâncias. Apesar de serem as forças intermoleculares mais fracas, sua influência é significativa, impactando diretamente aspectos como ponto de ebulição, solubilidade e até mesmo interações biológicas complexas.
Influência nas Propriedades Físicas
As forças de dispersão de London influenciam diretamente propriedades físicas como ponto de ebulição e solubilidade.
- Ponto de Ebulição:Quanto mais fortes as forças de dispersão de London entre as moléculas de uma substância, maior a energia necessária para superar essas forças e mudar o estado da matéria de líquido para gasoso. Isso significa que substâncias com forças de dispersão de London mais fortes tendem a ter pontos de ebulição mais altos.
Por exemplo, o butano (C 4H 10) tem um ponto de ebulição mais alto que o propano (C 3H 8) devido à maior superfície de contato e, consequentemente, forças de dispersão de London mais fortes entre as moléculas de butano.
- Solubilidade:A solubilidade de uma substância em outra depende da força das interações intermoleculares entre as moléculas do soluto e do solvente. Substâncias com forças de dispersão de London semelhantes tendem a ser mais solúveis uma na outra, pois as interações entre as moléculas do soluto e do solvente são fortes o suficiente para superar as forças de dispersão de London entre as moléculas do soluto e do solvente.
Por exemplo, o hexano (C 6H 14) é solúvel em heptano (C 7H 16) porque ambos são hidrocarbonetos apolares com forças de dispersão de London semelhantes.
Papel em Processos Biológicos
As forças de dispersão de London desempenham um papel fundamental em processos biológicos, como a interação entre proteínas e DNA.
- Interação entre Proteínas e DNA:As proteínas e o DNA são moléculas complexas que interagem através de uma variedade de forças intermoleculares, incluindo as forças de dispersão de London. Essas forças contribuem para a estabilidade das estruturas tridimensionais das proteínas e para a ligação específica entre proteínas e DNA.
Por exemplo, as forças de dispersão de London entre os grupos aromáticos nas bases nitrogenadas do DNA e os aminoácidos aromáticos nas proteínas contribuem para a formação de ligações específicas entre proteínas e DNA.
Importância em Áreas como a Indústria Farmacêutica e a Ciência dos Materiais
As forças de dispersão de London têm um papel crucial em áreas como a indústria farmacêutica e a ciência dos materiais.
- Indústria Farmacêutica:A compreensão das forças de dispersão de London é essencial para o desenvolvimento de novos medicamentos. As forças de dispersão de London influenciam a interação entre os medicamentos e seus alvos moleculares, impactando a eficácia e a segurança dos medicamentos.
Por exemplo, a interação entre um medicamento e uma proteína alvo pode ser influenciada pela força das forças de dispersão de London entre as moléculas do medicamento e os aminoácidos da proteína.
- Ciência dos Materiais:As forças de dispersão de London são cruciais na ciência dos materiais, especialmente na área de polímeros e materiais compostos. Essas forças influenciam as propriedades mecânicas e térmicas dos materiais, como a resistência, a rigidez e o ponto de fusão.
Por exemplo, a força das forças de dispersão de London entre as cadeias poliméricas influencia a resistência e a rigidez do material.
Aplicações das Forças de Dispersão de London: Exemplos De Força De Dispersão De London
As forças de dispersão de London, embora consideradas fracas, desempenham um papel crucial em uma variedade de fenômenos químicos e processos tecnológicos. Sua influência é evidente em diferentes áreas da ciência, desde a separação de compostos em cromatografia gasosa até a compreensão das propriedades de materiais.
Cromatografia Gasosa, Exemplos De Força De Dispersão De London
A cromatografia gasosa (CG) é uma técnica de separação que explora as diferentes volatilidades dos componentes de uma mistura. A volatilidade, por sua vez, é influenciada pelas forças intermoleculares presentes entre as moléculas. As forças de dispersão de London desempenham um papel importante na CG, especialmente na separação de compostos apolares.
Em resumo, a CG é um método que separa os componentes de uma mistura com base na sua volatilidade. As forças de dispersão de London influenciam a volatilidade dos compostos, impactando diretamente a eficiência da separação.
Espectroscopia de Infravermelho
A espectroscopia de infravermelho (IV) é uma técnica analítica que utiliza a radiação infravermelha para identificar e quantificar moléculas. A absorção de radiação IV por uma molécula resulta em vibrações moleculares específicas, que são detectadas e analisadas para determinar a estrutura da molécula.
As forças de dispersão de London influenciam as vibrações moleculares, afetando os espectros de IV.
A espectroscopia de IV é uma ferramenta poderosa para a identificação e análise de moléculas. As forças de dispersão de London influenciam as vibrações moleculares, impactando os espectros de IV.
Desenvolvimento de Novos Materiais
O conhecimento das forças de dispersão de London é essencial para o desenvolvimento de novos materiais com propriedades específicas. As forças de dispersão de London podem ser manipuladas para controlar as propriedades físicas e químicas dos materiais, como ponto de fusão, ponto de ebulição, viscosidade e solubilidade.
Compreender as forças de dispersão de London é crucial para o desenvolvimento de novos materiais com propriedades específicas. A manipulação dessas forças permite o controle de propriedades como ponto de fusão, ponto de ebulição, viscosidade e solubilidade.
Aplicações em Diferentes Áreas da Química e da Ciência
As forças de dispersão de London têm aplicações em várias áreas da química e da ciência, incluindo:
- Química Orgânica:As forças de dispersão de London são responsáveis pela solubilidade de compostos orgânicos apolares em solventes apolares. Por exemplo, o hexano é solúvel em éter dietílico devido às forças de dispersão de London entre as moléculas de hexano e éter dietílico.
- Química Inorgânica:As forças de dispersão de London são importantes na compreensão das propriedades de compostos inorgânicos, como o ponto de fusão e o ponto de ebulição. Por exemplo, o ponto de ebulição do gás nobre hélio é extremamente baixo devido à fraca força de dispersão de London entre os átomos de hélio.
- Bioquímica:As forças de dispersão de London são importantes para a interação entre moléculas biológicas, como proteínas e ácidos nucléicos. Por exemplo, as forças de dispersão de London contribuem para a estrutura tridimensional das proteínas.
- Ciência dos Materiais:As forças de dispersão de London são importantes para a compreensão das propriedades de materiais, como a resistência mecânica e a condutividade térmica. Por exemplo, a força de dispersão de London entre as moléculas de grafite é responsável pela sua alta resistência mecânica.
As forças de dispersão de London são um exemplo fascinante de como as interações intermoleculares podem ter um impacto significativo nas propriedades físicas e químicas das substâncias. Ao explorar os exemplos de forças de dispersão de London, podemos apreciar a complexidade e a beleza da química, compreendendo como essas forças influenciam o mundo ao nosso redor.

