A Teoria De Um Exercio De Quimica Transformação Isobárica Exemplos – A Teoria De Um Exercício De Química: Transformação Isobárica e Exemplos mergulha no fascinante mundo da termodinâmica, explorando a transformação isobárica, um processo fundamental em reações químicas que ocorre sob pressão constante. Esta teoria é crucial para compreender como a energia é transferida e transformada em sistemas químicos, e como a pressão constante afeta o trabalho realizado durante reações.
A transformação isobárica é um conceito chave na termodinâmica, que descreve o comportamento de sistemas químicos quando submetidos a mudanças de temperatura e volume, mantendo a pressão constante. A primeira lei da termodinâmica, que afirma que a energia não pode ser criada nem destruída, mas apenas transformada, é fundamental para entender a transformação isobárica.
Ao analisarmos a primeira lei da termodinâmica, podemos compreender como a energia interna de um sistema varia durante uma transformação isobárica, considerando o calor trocado com o ambiente e o trabalho realizado pelo sistema.
Introdução à Termodinâmica
A termodinâmica é um ramo da física que estuda as relações entre calor, trabalho e energia interna em sistemas físicos. É uma disciplina fundamental em diversas áreas, como química, engenharia, meteorologia e biologia. Os conceitos termodinâmicos são essenciais para compreender as transformações de energia que ocorrem nos sistemas químicos e físicos, desde reações químicas até a geração de energia.
Conceitos Fundamentais da Termodinâmica
A termodinâmica se baseia em alguns conceitos fundamentais que são essenciais para entender o comportamento dos sistemas termodinâmicos. Esses conceitos incluem:
- Temperatura:Uma medida da energia cinética média das partículas de um sistema. Quanto maior a temperatura, maior a energia cinética das partículas, e, portanto, maior o movimento molecular.
- Calor:A transferência de energia térmica entre sistemas com temperaturas diferentes. O calor flui espontaneamente do sistema de maior temperatura para o sistema de menor temperatura.
- Trabalho:A energia transferida para um sistema quando uma força atua sobre ele e o desloca. O trabalho pode ser realizado de várias formas, como a expansão de um gás ou o movimento de um objeto.
- Energia Interna:A energia total armazenada em um sistema, incluindo a energia cinética e potencial das partículas que o compõem. A energia interna de um sistema pode variar com a temperatura, pressão e composição.
A Primeira Lei da Termodinâmica
A primeira lei da termodinâmica é um princípio fundamental que afirma que a energia total de um sistema isolado permanece constante. Em outras palavras, a energia não pode ser criada nem destruída, apenas transformada de uma forma para outra. A primeira lei da termodinâmica pode ser expressa pela equação:
ΔU = Q
W
onde ΔU é a variação da energia interna do sistema, Q é o calor adicionado ao sistema e W é o trabalho realizado pelo sistema. Essa equação indica que a variação da energia interna de um sistema é igual à diferença entre o calor adicionado e o trabalho realizado.
Em sistemas químicos, a primeira lei da termodinâmica é aplicada para entender as mudanças de energia que ocorrem durante as reações químicas. A variação de entalpia (ΔH) é uma medida da mudança de energia interna em uma reação química realizada sob pressão constante.
A entalpia é uma função de estado, o que significa que seu valor depende apenas do estado inicial e final do sistema, e não do caminho percorrido.
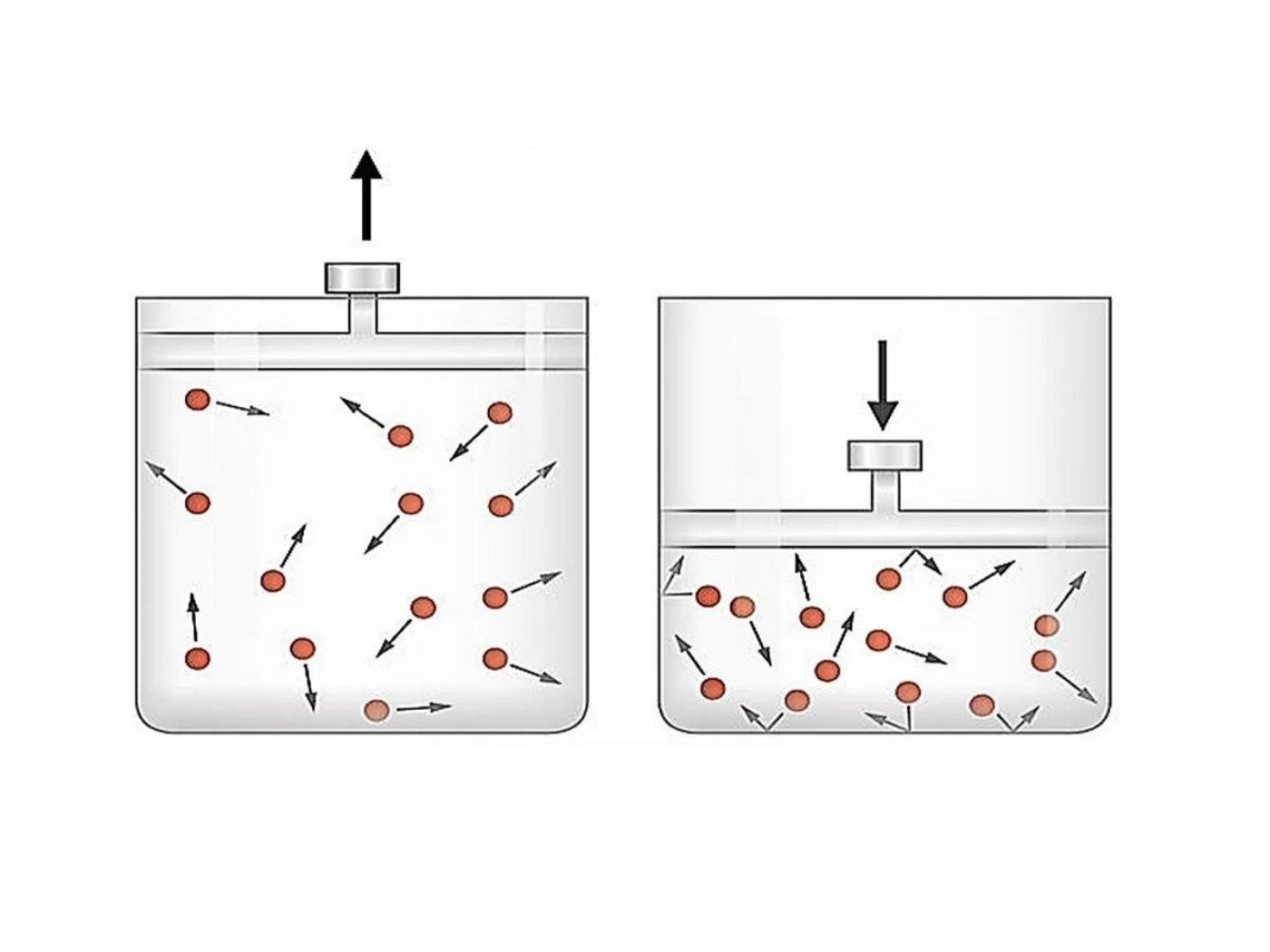
Processo Isobárico
Um processo isobárico é um processo termodinâmico que ocorre sob pressão constante. Em um processo isobárico, a pressão do sistema permanece constante, enquanto outras variáveis, como volume e temperatura, podem variar. A pressão constante é uma condição comum em muitos processos químicos e físicos, como reações químicas em recipientes abertos e o aquecimento de um gás em um recipiente fechado.
A Teoria da Transformação Isobárica: A Teoria De Um Exercio De Quimica Transformação Isobárica Exemplos

A transformação isobárica é um processo termodinâmico que ocorre a pressão constante. Essa condição é frequentemente encontrada em reações químicas e processos físicos, e é crucial para entender o comportamento de sistemas sob condições de pressão constante.
Definição de uma Transformação Isobárica
Uma transformação isobárica é definida como um processo termodinâmico onde a pressão do sistema permanece constante durante toda a transformação. Isso significa que, embora outras variáveis como volume e temperatura possam mudar, a pressão do sistema permanece inalterada. Uma transformação isobárica pode ser representada graficamente em um diagrama P-V (pressão versus volume) como uma linha horizontal, pois a pressão permanece constante durante todo o processo.
Características de um Sistema que Sofre uma Transformação Isobárica
Um sistema que sofre uma transformação isobárica apresenta as seguintes características:
- Pressão Constante:A pressão do sistema permanece constante durante todo o processo.
- Variação de Volume:O volume do sistema pode variar durante a transformação, dependendo da natureza do processo. Em geral, o volume aumenta com o aumento da temperatura e diminui com a diminuição da temperatura.
- Variação de Temperatura:A temperatura do sistema pode variar durante a transformação, dependendo da quantidade de calor adicionado ou removido do sistema.
- Trabalho Realizado:O trabalho realizado durante uma transformação isobárica é dado pela fórmula: W = PΔV, onde P é a pressão constante e ΔV é a variação de volume.
Como a Pressão Constante Afeta o Trabalho Realizado
A pressão constante em uma transformação isobárica influencia diretamente o trabalho realizado pelo sistema. O trabalho realizado é diretamente proporcional à variação de volume, o que significa que quanto maior a variação de volume, maior o trabalho realizado. A pressão constante atua como uma força constante que realiza o trabalho sobre o sistema, resultando em uma mudança de volume.
Por exemplo, em um sistema com um gás ideal, o trabalho realizado durante uma expansão isobárica é dado pela fórmula W = PΔV, onde P é a pressão constante e ΔV é a variação de volume. O trabalho realizado é positivo durante a expansão, pois o sistema realiza trabalho sobre o ambiente, e negativo durante a compressão, pois o ambiente realiza trabalho sobre o sistema.
Exemplos de Transformações Isobáricas
A transformação isobárica é um conceito importante em química e física, e ocorre em uma variedade de situações. Aqui estão alguns exemplos de transformações isobáricas:
Reação Química Sob Pressão Constante
Uma reação química que ocorre em um recipiente aberto, como uma panela, é um exemplo de uma reação que ocorre sob pressão constante. A pressão atmosférica é constante, e a reação ocorre sem uma mudança significativa na pressão. A reação de combustão de um combustível em uma chama é um exemplo de uma reação química que ocorre sob pressão constante.
Aquecimento de um Gás Ideal em um Recipiente Fechado
O aquecimento de um gás ideal em um recipiente fechado com um pistão móvel é outro exemplo de uma transformação isobárica. Se o pistão for móvel, a pressão dentro do recipiente permanecerá constante. O aumento da temperatura do gás fará com que ele se expanda, e o pistão se moverá para cima para manter a pressão constante.
O trabalho realizado pelo gás é então dado por W = PΔV, onde P é a pressão constante e ΔV é a variação de volume.
Variação de Volume em uma Transformação Isobárica
A variação de volume em uma transformação isobárica pode ser calculada usando a lei de Charles, que afirma que o volume de um gás ideal é diretamente proporcional à sua temperatura absoluta, sob pressão constante. A equação para a lei de Charles é:
V1/T 1= V 2/T 2
onde V 1e T 1são o volume e a temperatura inicial do gás, e V 2e T 2são o volume e a temperatura final do gás. Usando essa equação, podemos calcular a variação de volume em uma transformação isobárica, conhecendo a temperatura inicial e final do gás.
Aplicações da Teoria da Transformação Isobárica
A teoria da transformação isobárica tem aplicações importantes em diversas áreas da química e da engenharia. Algumas das aplicações mais importantes são:
Processos Industriais
A transformação isobárica é amplamente aplicada em processos industriais, como a produção de energia. Por exemplo, em usinas de energia a vapor, a água é aquecida em uma caldeira sob pressão constante para gerar vapor. O vapor então passa por uma turbina, realizando trabalho para gerar energia.
O processo de produção de vapor em uma caldeira é um exemplo de uma transformação isobárica.
Estudos de Cinética Química
A transformação isobárica é importante em estudos de cinética química, pois permite o estudo das taxas de reação em condições de pressão constante. As taxas de reação são afetadas pela pressão, e a transformação isobárica garante que a pressão seja constante, permitindo uma análise precisa das taxas de reação.

