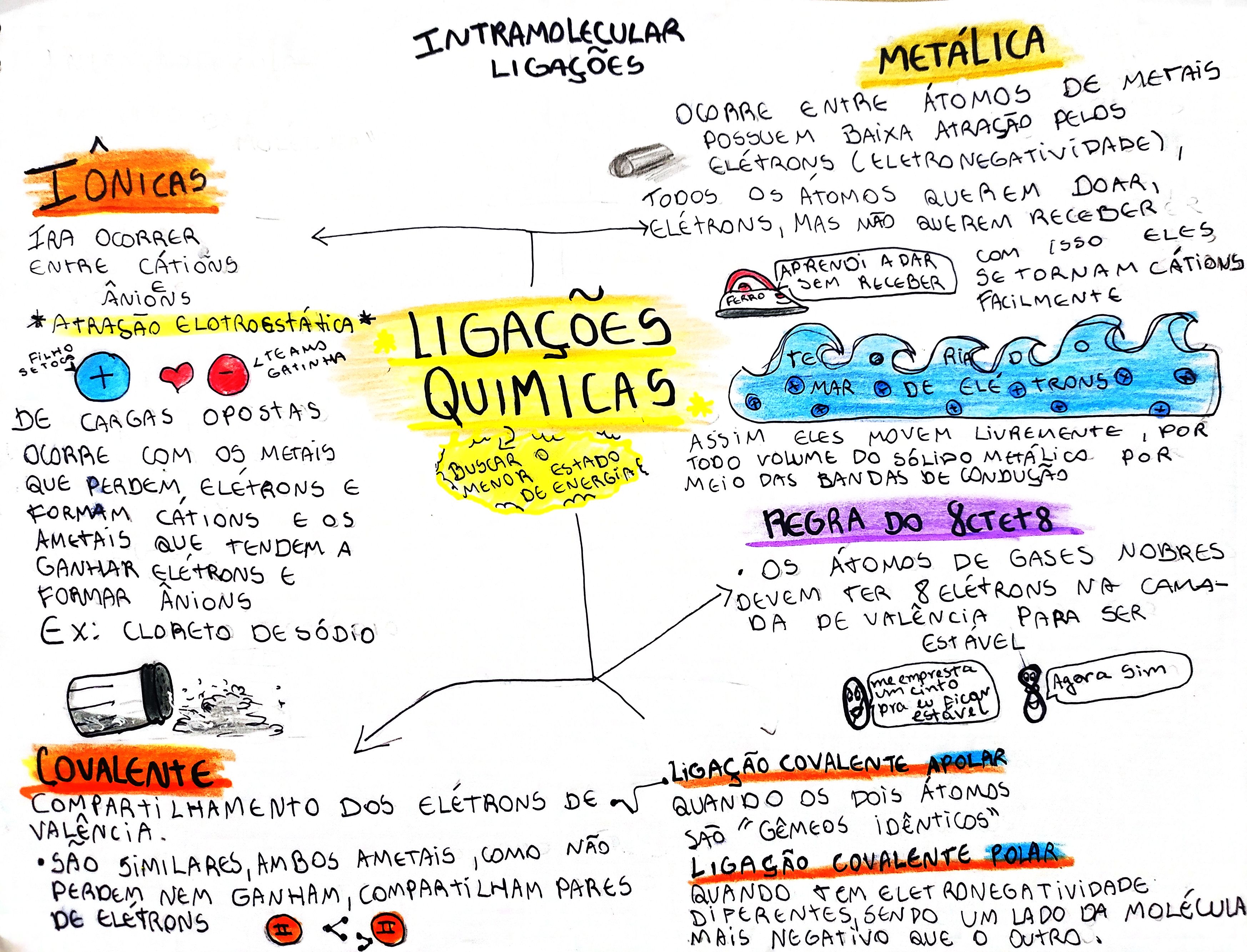
Ligações Químicas: Uma Abordagem Detalhada: 5 Exemplos Das Ligaçoes Quimicas Ionicas Covalentes E Metalicas Brinly
Exemplos Das Ligaçoes Quimicas Ionicas Covalentes E Metalicas Brinly – A compreensão das ligações químicas é fundamental para a química, pois explica como os átomos se unem para formar moléculas e compostos, influenciando diretamente as propriedades da matéria. Existem três tipos principais de ligações químicas: iônica, covalente e metálica, cada uma caracterizada por diferentes mecanismos de interação entre átomos e consequentemente, diferentes propriedades físicas e químicas.
Tipos de Ligações Químicas: Uma Visão Geral, 5 Exemplos Das Ligaçoes Quimicas Ionicas Covalentes E Metalicas Brinly
A eletronegatividade, que mede a capacidade de um átomo atrair elétrons em uma ligação, desempenha um papel crucial na classificação dos tipos de ligações. A tabela a seguir resume as características principais de cada tipo:
| Nome da Ligação | Tipo de Elemento Envolvido | Transferência/Compartilhamento de Elétrons | Exemplo |
|---|---|---|---|
| Iônica | Metal e não-metal | Transferência de elétrons | NaCl |
| Covalente | Não-metais | Compartilhamento de elétrons | H₂O |
| Metálica | Metais | Mar de elétrons | Fe |
Ligação Iônica: Detalhes e Exemplos
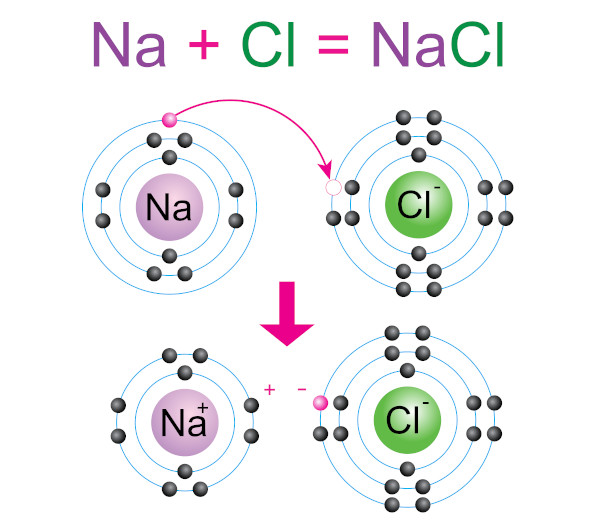
A ligação iônica ocorre pela transferência de elétrons de um átomo menos eletronegativo (metal) para um átomo mais eletronegativo (não-metal), resultando em íons com cargas opostas que se atraem eletrostaticamente. Observemos o cloreto de sódio (NaCl) e o óxido de magnésio (MgO) como exemplos.
No NaCl, o sódio (Na), um metal alcalino, perde um elétron para se tornar um cátion Na +, enquanto o cloro (Cl), um halogênio, ganha esse elétron, formando um ânion Cl –. A atração eletrostática entre esses íons opostos forma o composto iônico NaCl, que possui uma estrutura cristalina cúbica.
O MgO, por sua vez, apresenta o magnésio (Mg) perdendo dois elétrons para se tornar Mg 2+, e cada átomo de oxigênio (O) ganhando dois elétrons para formar O 2-. A estrutura cristalina do MgO também é cúbica, porém com uma organização diferente dos íons em comparação ao NaCl, devido às diferentes cargas iônicas.
A estrutura cristalina do MgO pode ser visualizada como um arranjo tridimensional de íons Mg 2+ e O 2-, onde cada íon Mg 2+ está cercado por seis íons O 2- e vice-versa, formando uma rede cristalina estável devido à forte atração eletrostática entre os íons de cargas opostas.
Ligação Covalente: Detalhes e Exemplos
A ligação covalente envolve o compartilhamento de elétrons entre átomos, geralmente não-metais, para atingir a estabilidade eletrônica. A água (H₂O) e o dióxido de carbono (CO₂) ilustram bem esse tipo de ligação.
Na molécula de água, cada átomo de hidrogênio (H) compartilha um par de elétrons com o átomo de oxigênio (O), formando duas ligações covalentes simples. A geometria molecular da água é angular, devido aos pares de elétrons não-ligantes no oxigênio.
O dióxido de carbono (CO₂) apresenta ligações covalentes duplas entre o carbono (C) e cada átomo de oxigênio (O). A geometria molecular é linear, com os átomos de oxigênio em lados opostos do átomo de carbono.
A água apresenta ponto de ebulição (100°C) significativamente mais alto que o dióxido de carbono (-78°C), devido às ligações de hidrogênio intermoleculares na água, que são mais fortes que as forças de van der Waals presentes no CO₂. A solubilidade em água também difere: o CO₂ é pouco solúvel, enquanto a água é o solvente universal, devido à sua polaridade.
Ligação Metálica: Detalhes e Exemplos
A ligação metálica é caracterizada por um “mar de elétrons” onde os elétrons de valência dos átomos metálicos são deslocalizados e compartilhados entre todos os átomos do metal. O ferro (Fe) e o cobre (Cu) são exemplos clássicos.
No ferro, os elétrons de valência são livres para se moverem por toda a estrutura cristalina, resultando em alta condutividade elétrica e térmica, além de maleabilidade e ductilidade. A estrutura cristalina do ferro pode variar dependendo da temperatura, apresentando diferentes formas alotrópicas.
O cobre, semelhante ao ferro, também apresenta um “mar de elétrons”, conferindo-lhe excelentes propriedades de condutividade elétrica e térmica, maleabilidade e ductilidade. No entanto, o cobre apresenta condutividade elétrica superior à do ferro, devido à sua estrutura eletrônica específica.
| Propriedade | Ferro (Fe) | Cobre (Cu) |
|---|---|---|
| Condutividade Elétrica | Moderada | Alta |
| Maleabilidade | Alta | Alta |
| Ductilidade | Alta | Alta |
Comparação das Ligações Químicas
As propriedades físicas dos materiais estão intimamente relacionadas ao tipo de ligação química presente. Uma comparação entre os três tipos de ligações é apresentada a seguir:
- Ponto de Fusão e Ebulição: Compostos iônicos geralmente apresentam altos pontos de fusão e ebulição devido à forte atração eletrostática entre os íons. Compostos covalentes apresentam pontos de fusão e ebulição variáveis, dependendo da força das interações intermoleculares. Metais geralmente apresentam altos pontos de fusão e ebulição, exceto os metais alcalinos.
- Condutividade Elétrica: Compostos iônicos conduzem eletricidade quando fundidos ou dissolvidos em água, devido à mobilidade dos íons. Compostos covalentes geralmente são isolantes, exceto alguns ácidos fortes. Metais são excelentes condutores de eletricidade devido à mobilidade dos elétrons no “mar de elétrons”.
- Maleabilidade e Ductilidade: Metais são maleáveis (podem ser moldados) e dúcteis (podem ser transformados em fios) devido à capacidade dos átomos metálicos de deslizar uns sobre os outros sem quebrar as ligações metálicas. Compostos iônicos e covalentes são geralmente frágeis.
Concluímos nossa exploração das ligações químicas iônicas, covalentes e metálicas, tendo desvendado a beleza e a complexidade das forças que governam a união entre átomos. De exemplos cotidianos como o sal e a água, a metais essenciais como o ferro e o cobre, observamos como as diferentes naturezas dessas ligações resultam em propriedades físicas e químicas distintas. Compreender esses princípios fundamentais é essencial para avançar em diversas áreas da ciência e tecnologia, abrindo portas para inovações em materiais, energia e muito mais.
A jornada pelo mundo microscópico nos revelou a grandiosidade da química, e esperamos que você tenha apreciado essa viagem ao centro da matéria!

